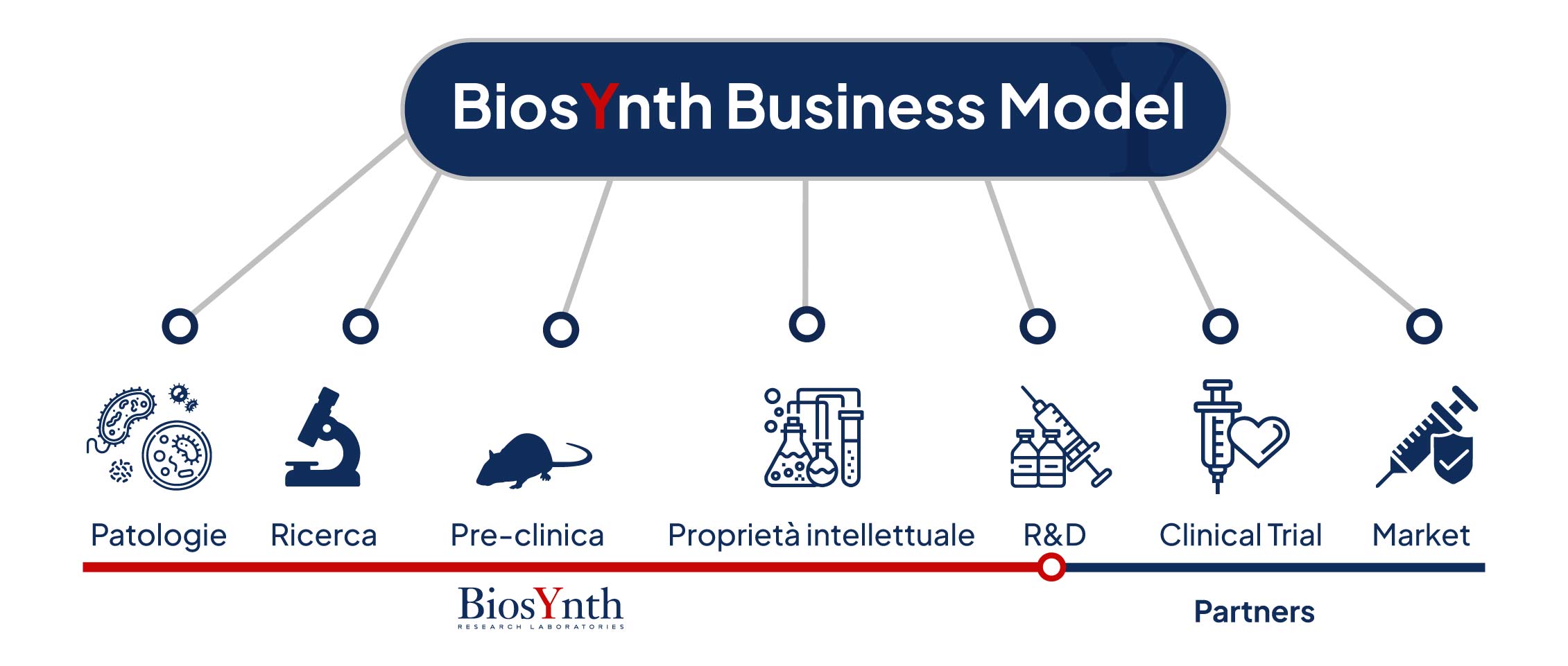
Nel contesto dello sviluppo di un vaccino per uso umano, il modello di business di BiosYnth si articola in fasi successive, che vanno dalla scoperta scientifica
fino alla Ricerca e Sviluppo post-test preclinici. Tutte le attività vengono svolte in strutture
conformi agli standard GLP (Good Laboratory Practice), a garanzia della qualità,
tracciabilità e affidabilità dei dati generati durante l'intero processo di sviluppo.
Ecco
come si può delineare il processo:
1. Patologia : La prima fase consiste nell'identificare una specifica malattia infettiva per cui è necessario un vaccino sulla base delle segnalazioni epidemiologiche rilasciate dal WHO. Può trattarsi quindi di una nuova malattia infettiva o di una malattia conosciuta per la quale però non esiste ancora un vaccino efficace o una malattia emergente oppure una per cui i vaccini esistenti potrebbero essere migliorati. La selezione della malattia guida quindi la direzione della ricerca di base e dello sviluppo conseguente.
2. Ricerca : La fase di ricerca si concentra sulla comprensione del patogeno responsabile della malattia, come virus o batteri, e su come il sistema immunitario umano risponde ad esso. Questo include l'identificazione di antigeni fenotipo-specifici che possono essere utilizzati per provocare una risposta immunitaria protettiva nell’organismo ospite (corpo).
3. Pre-clinica : Durante la fase pre-clinica, i candidati vaccini vengono testati in vitro e in modelli animali per valutare la loro sicurezza e capacità di indurre una risposta immunitaria specifica e potenzialmente efficace. Questi studi sono cruciali per determinare quali formulazioni avanzare nella successiva sperimentazione clinica.
4. Proprietà intellettuale: La protezione delle scoperte attraverso brevetti d’invenzione è essenziale per il know-how sviluppato comprendente gli antigeni, adiuvanti, metodi di produzione del vaccino e le formulazioni che risultano dalla ricerca sulla base delle indicazioni pre-cliniche. Questa protezione consente a BiosYnth di mantenere un vantaggio competitivo e di attrarre investimenti da parte di partners industriali e commerciali.
5. R&D (Ricerca e Sviluppo): La R&D prosegue in tutte le fasi dello sviluppo del vaccino su scala pilota, inclusa l’ottimizzazione della formulazione e il perfezionamento dei metodi di produzione. Tutte le attività sono condotte in strutture conformi alle Buone Pratiche di Laboratorio (GLP), garantendo rigore scientifico, tracciabilità e qualità dei dati sperimentali.
6. Clinical Trial (con i Partners): Data la complessità e il costo elevato degli studi clinici, trovare partners strategici è fondamentale. Questi possono essere grandi aziende farmaceutiche o governi nazionali o Istituzioni pubbliche e/o private. Questi partners possono fornire finanziamenti, infrastrutture di ricerca e accesso organizzato a popolazioni di studio clinico.
7. Mercato (con i Partners): Dopo aver completato con successo gli studi clinici e ottenuta l'approvazione regolatoria dagli Enti preposti (Marketing Authorization), il passaggio successivo è la commercializzazione del vaccino. In collaborazione con i partners, si utilizzano canali di distribuzione esistenti e già strutturati da esperienze pregresse nel mercato dei vaccini e con appropriate strategie di marketing per raggiungere un ampio pubblico che possa beneficiarne. Questa fase include anche attività come la produzione su larga scala, la gestione della catena del freddo (per i vaccini che richiedono refrigerazione e temperatura controllata), e programmi di monitoraggio post-commercializzazione per valutare l'efficacia e la sicurezza a lungo termine del vaccino.

